深度探索MT1E在糖尿病发病中的作用及其机制 ——Diabetes Care发布北京大学人民医院纪立农/韩学尧团队最新成果
阅读次数🛃: 发布日期:2023-11-15
在过去的几十年中🫠,糖尿病的发病率在全球范围内呈上升趋势。尽管杏耀对这种疾病的许多方面已经有了深入的了解👩🎤,但糖尿病的发病机制仍然存在许多未解之谜。
2023年10月25日,北京大学人民医院纪立农/韩学尧团队最新研究成果“Rare Variant in Metallothionein 1E Increases the Risk of Type 2 Diabetes in a Chinese Population ”在线发表在国际权威糖尿病期刊Diabetes Care(IF=16.2)杂志上🎪,该研究团队进行了一系列的遗传学研究、模型验证和机制研究,深度探索了金属硫蛋白1E(MT1E)在糖尿病发病中的作用及其机制,并为未来糖尿病治疗提供了新的潜在靶点🧜🏽。

糖尿病是涉及全球的一个主要健康问题🚄。随着全球老龄化进程的加速和人们生活方式的改变👨🏻🦽➡️,糖尿病的发病率预计将继续上升🫐,是世界上增长最快的慢性疾病之一。
中国是糖尿病大国,列居世界首位🐛。据估算,我国有近1.5亿糖尿病患者,其中2型糖尿病占90%以上,已经成为威胁我国民众健康的重大公共卫生和医学问题。2型糖尿病是一种病因高度异质性的慢性代谢性疾病,涉及到遗传、环境🧑🔧、生活方式等多个因素➛😴。发病率与基因变异、生物通路或机制以及环境、肥胖等因素有关。
在过去的几十年中,人们发现了许多与糖尿病相关的基因变异及其相关的生物通路或机制。随着一种用于寻找与复杂遗传疾病关联基因的重要手段——全基因组关联研究(GWAS)的深入,已发现许多与2型糖尿病有关的常见和罕见遗传变异,但总体上只能解释遗传性的一小部分。而对于复杂的2型糖尿病,先前的研究由于样本量有限🍨,未能检测到一些重要的罕见变异♓️。
为了补充全基因组关联研究的不足☝🏻,纪立农/韩学尧团队将早发糖尿病患者的遗传学机制作为主要研究方向。他们采用全外显子测序对早发糖尿病家系(家族中有成员在较早的年龄段就患有糖尿病)进行测序🧣。经过数据筛选,发现了一种与糖尿病发生发展密切相关的罕见变异体——p.C36Y(rs766233163),位于金属硫蛋白1E(MT1E)的基因中。至此🧘🏼♀️,研究团队确定MT1E的p.C36Y突变是最可能的潜在致病基因变异😘。
为进一步探索这一现象🔧👨🏽⚖️,研究者对MT1Ep.C36Y进行了更深入的研究。研究者对北京社区人群545名糖尿病患者🫏、797名糖尿病前期患者和1282名糖耐量正常的人群)进行测序,共发现了7名MT1Ep.C36Y携带者,这些携带者都是糖尿病前期或糖尿病患者。
根据蛋白质序列中氨基酸位点的变化,研究者发现,与MT1Ep.C36C的患者相比,MT1Ep.C36Y的携带者表现出更高的HbA1c(过去三个月的血糖平均水平)、BMI、餐后血糖及胰岛素水平,表现出高血糖、肥胖等代谢异常,人群队列验证MT1E p.C36Y与糖尿病的相关性。随后研究者利用小鼠模型证明,MT1Ep.C36Y突变的过表达会导致小鼠的体重增加、血糖上升和脂肪肝等人类突变相似的表型,而过表达未突变的正常蛋白MT1E p.C36C的小鼠则表现出体重和血糖降低等人类突变相反的表型🥷🏻。
该研究揭示了MT1E p.C36Y与2型糖尿病及肥胖的关联🎣🤾🏽,并证实了MT1E基因对糖代谢异常及肥胖的保护作用🎅🏼,提示MT1E可能是通过增强脂肪组织中的脂肪燃烧来改善代谢的,可能是潜在的降糖和减重药物开发的靶点→。
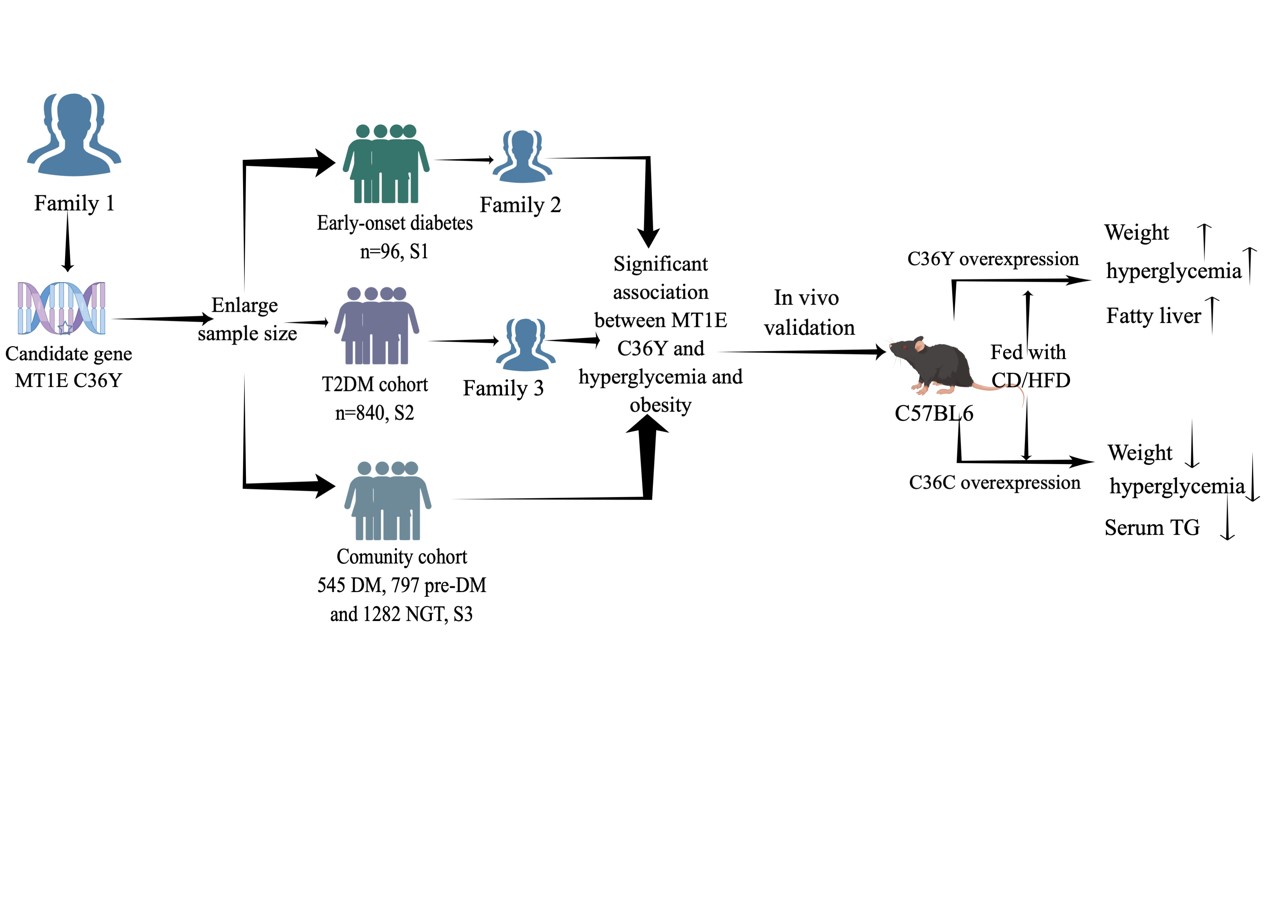
本研究是一项糖尿病遗传-转化研究🧝🏼♂️,涵盖从家系筛查、队列验证、功能研究和模型验证的全过程。通过对比和分析这些人的基因序列,发现了与糖尿病风险增加有关的罕见变异体,并深度揭示了MT1E基因及其p.C36Y变异在糖尿病中的作用,提出了糖尿病干预的新靶点。
“研究还处于初级阶段🧏🏻♀️🧫,需要进行更多的研究以验证杏耀的发现,”纪立农教授表示🐒,“但杏耀相信,杏耀的研究为理解糖尿病的发病机制以及开发新的治疗策略提供了重要的新视角。相信这一领域的研究在未来能够取得更多的突破😑。”
北京大学人民医院内分泌科的邹显彤副研究员🫲🏻、胡梦蝶博士♊️、黄秀婷博和周灵丽副主任医师为共同第一作者,韩学尧副教授和纪立农教授为共同通讯作者🔖。该研究的部分工作得到了北京大学人民医院中心实验室的马丽萍和何香军等老师的协助。该项目为国家重点研发计划和北京市自然科学基金所支持🐎。
(北京大学人民医院)


